家兔呼吸消化实验
点击下载 [相关资源]
本篇下载资源为本实验优秀实验报告示例。
目录
实验原理与基础知识
一. 哺乳动物呼吸运动的调节
哺乳动物的呼吸运动是呼吸肌节律性的舒缩产生的,这一活动起源于脑干当中呼吸中枢的周期性活动。呼吸中枢主要由延髓和脑桥中的数个核团组成,其中的神经元可以周期性地自发产生兴奋,负责产生基础呼吸节律;在此之上,多种通路同时对呼吸中枢起到调节作用,使呼吸活动适应生理需求。呼吸中枢当中具有对氢离子(H+)敏感的区域,脑脊液pH下降时,呼吸中枢受到刺激,可导致呼吸运动加快加深。血液中的CO2含量(以血二氧化碳分压,即PCO2计)虽然不会直接被呼吸中枢感知,但当血液PCO2升高时,更多CO2扩散穿过血脑屏障并溶解在脑脊液中,使脑脊液PCO2也上升。CO2与水反应生成碳酸,进而解离出H+,导致脑脊液pH下降,进而增强呼吸中枢的活动。血液中O2含量(以血氧分压,即PO2计)对呼吸中枢本身没有显著影响,但机体的外周化学感受器颈动脉体和主动脉体可感知血液PO2,在PO2下降时作出响应,刺激呼吸中枢,同样产生使呼吸加快加深的效果。此种生理反应可以增强气体交换,使更多O2被摄入,或使更多CO2被排出,进而恢复血液PO2或pH值。
除化学感受器之外,呼吸道上分布有机械感受器,它们感受肺部体积及张力的变化,对呼吸中枢也起着调节作用。机械信号传入对呼吸中枢影响的一个例子是肺牵张反射:吸气过程中,肺部机械感受器随着肺体积增大受到刺激,向呼吸中枢传递信号,促进吸气过程转变为呼气,防止吸气过长、肺部过度牵拉。这一反射的传入神经是迷走神经,因此刺激迷走神经可以导致吸气过程被抑制,而阻断迷走神经则可导致吸气过程延长。
二. 哺乳动物消化道活动
动物消化道各部分组织结构不同,运动的形式、作用及调控机制也有差异。一般而言,消化道的运动均包括两种基本类型:可保证消化道具有一定张力的紧张性收缩,以及可将内容物向前推进的蠕动。在此之外,消化道的不同部分为适应自身功能,各有独特的运动方式,如胃可在接收食物时发生容受性舒张,小肠的分节运动使食糜充分与消化液混合、促进消化与吸收等。这些活动通常较为缓慢,由消化道管壁平滑肌有规律的舒缩实现,而消化道平滑肌由肠道神经系统(ENS)和体液因素(循环中的激素)的活动调节,其中ENS又受到副交感神经与交感神经活动的调控。一般而言,神经末梢释放的乙酰胆碱可活化消化道平滑肌上的M受体,对平滑肌活动起到激活作用,而去甲肾上腺素、肾上腺素等儿茶酚胺类化学信使对平滑肌活动起到抑制作用。
小肠是营养物质吸收的主要区域,多种因素影响到肠内物质吸收效率,其中肠内容物的浓度与渗透压是一个重要的决定因素。对于同种物质的溶液而言,在一定范围内,溶质浓度越高,吸收效率越高;但如果溶液浓度过高,将造成反渗透现象,即因肠内容物相对高渗而使肠壁内水分渗入肠腔内,反而不利于吸收。多数营养物质的吸收通过次级主动转运实现,而水分本身的吸收是一个被动过程,随着溶质的吸收受渗透压推动而也被肠壁吸收。
实验目的
- 学习记录家兔呼吸运动曲线的方法
- 了解几种理化因素改变对呼吸运动的影响
- 观察在体条件下消化管的运动情况以及神经体液的调控作用
实验对象与器材
- 家兔(Oryctolagus cuniculus domesticus)
- 20%乌拉坦(氨基甲酸乙酯),台氏液(蒂罗德液),0.9%生理盐水, 3%乳酸,0.1%肾上腺素,0.1%乙酰胆碱,0.1%阿托品,5%葡萄糖,饱和硫酸镁,过饱和KCl
- 动物体重秤,防抓咬手套,兔手术台,兔保定器,哺乳动物手术器械, RM6240E型多道生理信号采集处理系统,刺激电极,刺激线,铁支架,双凹夹,气管插管,注射器,棉线,纱布,棉花
- 呼吸流量换能器,动脉夹,止血钳,保护电极,1.5m长橡胶管,万能滑轮,CO2气囊
关键实验技术
- 家兔的抓取、麻醉与固定
- 家兔耳缘静脉注射技术
- 气管插管技术
- 颈总动脉插管技术
实验前准备:麻醉与颈部手术
一. 动物的麻醉与固定
取一只家兔,称重,记录好体重数据,固定在保定器中。将20%乌拉坦(氨基甲酸乙酯)以5mL/kg(1g/kg)体重的剂量由耳缘静脉远端缓慢注入,观察动物肌张力、呼吸与角膜反射的变化。待肌张力松弛、呼吸减缓、角膜反射大大减弱或消失后,即可认为麻醉基本完成。动物麻醉后,背位固定于兔手术台上,手术台调至恒温40°C。
抓取动物时戴好防抓咬手套,避免受伤。将动物固定在保定器内时,应多观察动物的状态,避免固定太紧导致动物呼吸受阻,或太松导致固定不稳。
【特别提示】
麻醉这一步可能比想象中更为复杂。请参考常见问题一节中的详细说明。
二. 颈部手术
将动物头部固定,充分暴露颈部手术野。剪除颈部被毛。沿颈部正中线在喉头(甲状软骨)上一指至锁骨(胸骨角)上一指的地方作一个5~7cm的皮肤切口。钝性分离皮下组织及肌肉,暴露、分离气管。分离过程中注意避免伤及大血管,及时止血,以防出血或血凝块影响视野。
活用止血钳!除可快速止血外(具体描述见常见问题一节),止血钳也可以用于夹持、钝性分离较厚的结缔组织或较薄的肌层,扩大钝性分离时最早造成的切口,可以显著提高手术的速度。
需要使用剪刀时尽量小心,切勿伤及神经或大血管。
三. 气管插管
在气管下方穿一根粗结扎线,于甲状软骨下方第三与第四软骨环之间作倒T形切口,切口约占气管管径的1/3~1/2,沿向心方向插入气管插管,结扎固定。注意及时清理呼吸道中的粘液或血块。
如果插管后动物突然出现呼吸急促、明显挣扎等表现,则很可能气管本身或插管已经被粘液或血块阻塞。此时应立刻拔除插管,检查插管是否堵塞,同时使用小镊子夹持少量干燥棉花清理气管,并再次尝试插管。成功插管后,插管内部的冷凝水等可能会部分阻塞插管,导致动物呼吸出现异响。如果未对呼吸曲线造成显著影响,可先不理会。
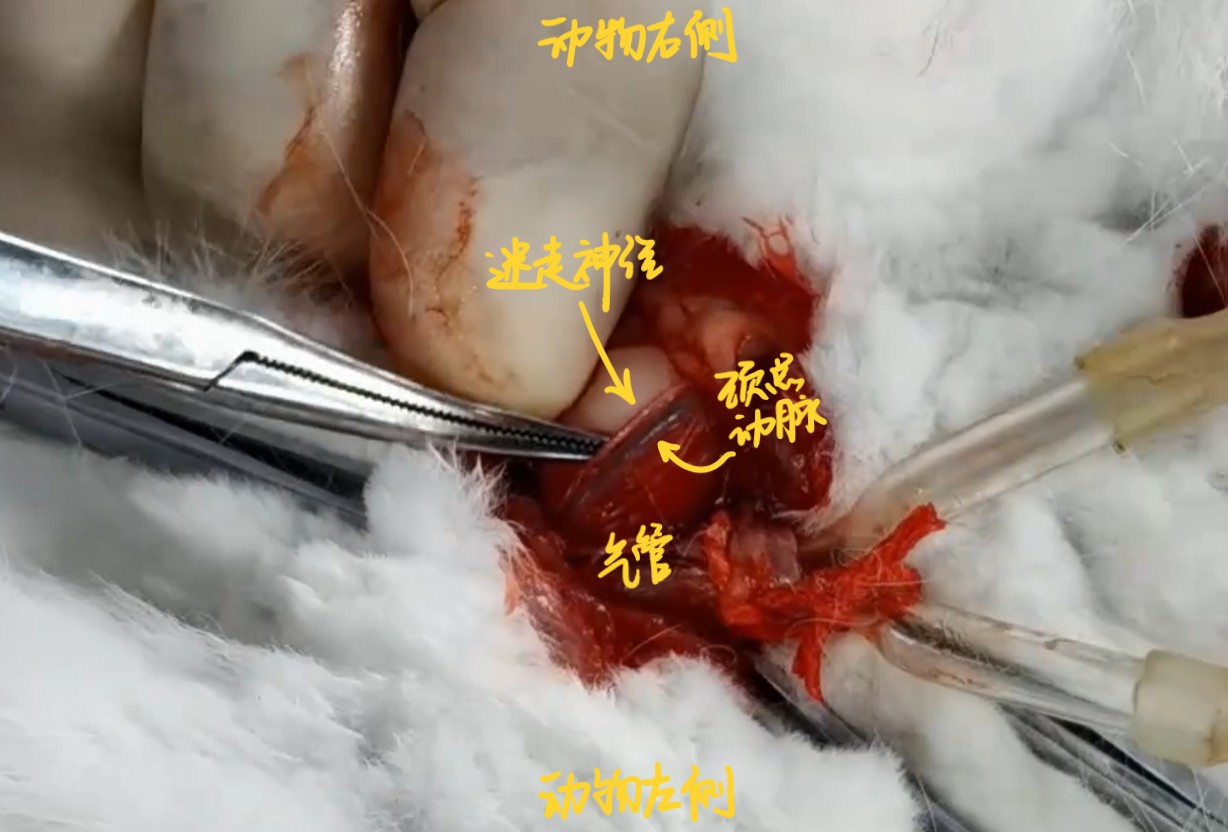
四. 分离迷走神经
在气管两侧辨别颈总动脉、迷走神经、交感神经、减压神经,在两侧迷走神经下方各穿两条湿润棉线备用。分离时特别注意不要过度牵拉,随时用台氏液润湿。
颈总动脉即为气管旁侧最显著的动脉;迷走神经在颈总动脉旁,是颈部神经中最粗大显著者,通常较易辨认。但迷走神经常常与颈总动脉包覆在同一层结缔组织内,需要小心分离。迷走神经之外的两条神经较细,需要特别注意避免损伤。此外,由于手术动作以及生理变异等原因,交感神经和减压神经未必能按照相对位置分辨,本实验中可先不分辨,如需要分辨时,可给予未知神经电刺激,通过观察刺激引发的生理反应判断神经的属性。
实验7 家兔呼吸运动的调节
一. 连接呼吸流量换能器
将气管插管的一侧支管通过橡皮管与呼吸流量换能器相连,另一侧支管与大气相通,呼吸流量换能器信号输出端与记录系统1通道相连。
二. 实验环节
-
正常呼吸曲线记录
打开软件,选择家兔呼吸运动调节实验,调节1通道为呼吸流量,记录为“流量mL/s (1L) ”,时间参数为1s。记录一段正常的呼吸运动曲线,同时观察吸气相和呼气相在呼吸曲线上的表现形式,注意呼吸幅度和频率。
时间参数即为系统界面最右侧自上往下数第四个选项。每次开始实验时最好都检查是否调整正确。
-
增加吸入气中的CO2浓度
将装有CO2的气囊管口靠近气管插管的游离侧支管,松开气囊的夹子,使部分CO2随吸气进入气管,观察呼吸的变化。一旦出现变化,立即去掉气囊,观察曲线的恢复过程。
-
增大无效腔
气管插管的游离侧支管和呼吸流量换能器游离侧支管同时分别连接长约1.50 m的橡胶管(或者气管插管的游离侧支管夹闭,呼吸流量换能器游离侧支管连接橡胶管),观察此时呼吸运动的变化。出现明显变化后,立即去掉橡胶管,观察恢复过程。
添加或去除橡胶管的过程本身就会对记录造成影响,观察时应忽略这部分噪声。
-
升高血液中H+浓度
用注射器由耳缘静脉缓慢注入3%乳酸0.5mL,使血液pH值降低,观察此时呼吸运动的变化及恢复过程。
乳酸对组织有很强的刺激作用,注射时务必缓慢,注射结束后按摩局部组织,促进吸收。乳酸吸收需要一定时间,且现象不一定非常显著,即使未观察到明显变化,也最好耐心等待一段时间再结束实验。
此外,无论注射时多小心,乳酸都会损伤血管,有可能废掉该侧的耳缘静脉,请做好心理准备。
-
迷走神经相关实验
由于涉及的操作(刺激神经等)与消化道实验中相同,本段实验可考虑与后续消化道实验共同进行。
先描记一段正常的呼吸曲线。调节刺激模式为“连续单刺激”,轻轻提起右侧迷走神经上的备用线,小心将神经置于保护电极上,用中等强度的连续刺激(约3~6V,20Hz)通过保护电极刺激神经,观察呼吸运动的变化。观察到变化后,立即停止刺激,观察呼吸运动的恢复。
切断神经的操作不可逆,建议在做完消化实验中与刺激迷走神经相关的部分后再行操作。
两端结扎、在中间剪断左侧迷走神经,观察呼吸运动有何变化。一段时间后,再切断右侧迷走神经,观察呼吸运动有何变化。
在此基础上,电刺激右侧迷走神经中枢端和外周端,分别观察呼吸运动是否发生变化。
实验8 家兔在体消化管活动观察与记录
一. 暴露胃和肠
剪掉腹部被毛,从耻骨联合前约5cm开始,向前沿腹中线打开腹腔约15~20cm,暴露胃和肠。观察正常情况下胃和小肠的蠕动,小肠的分节运动及其频率,用手指轻触胃部感受其紧张度。
二. 实验部分
-
小肠吸收与肠内容物渗透压的关系
此步等待时间较长,推荐先做。
取出一段长约16cm的空肠,用线将其扎成各为8cm长的肠段A和B。在A段中注入3~5mL饱和硫酸镁溶液,在 B 段中注入15~20mL 5%葡萄糖溶液。将A、B肠段放回腹腔,约30min后检查两肠的变化。
-
乙酰胆碱对消化管运动的影响
直接在胃和小肠表面滴加0.1%乙酰胆碱3~5滴,观察胃肠运动的变化。出现变化后立即用台氏液清洗几遍,观察其恢复。
-
肾上腺素对消化管运动的影响
恢复正常后直接在小肠表面滴加0.1%肾上腺素3~5滴,观察胃肠运动变化。
-
迷走神经对消化管运动的调节
通过保护电极刺激右迷走神经约15s,观察胃肠运动的变化及恢复。待恢复正常后,经耳缘静脉注射0.1%阿托品0.5mL,1~2min后对迷走神经进行电刺激,观察胃肠运动的变化。
注射阿托品后电刺激神经时,也可注意呼吸曲线的改变。阿托品是否会对刺激迷走神经后呼吸运动的变化产生影响?为什么?
以上实验结束后,如有空余时间,可以现场尝试选做实验:内脏大神经对消化道运动的影响和动脉插管操作。
三. 动物处死
经家兔耳缘静脉快速注射过饱和KCl溶液1~2mL,同时密切注意动物状态变化,直至动物呼吸、心跳均消失。
注意事项
- 麻醉剂注射量速度要慢,同时注意动物的变化,以免过量引起动物死亡。如果实验时间过长,动物苏醒挣扎,可适量补充麻醉剂。
- 注意保护神经不要过渡牵拉,并经常保持湿润。
- 每项实验前要有观察对照,施加条件时要按“标记”。注射每种试剂的注射器要专用,不可混用。
- 耳缘静脉注射乳酸时要注意控制好速度,以免造成因局部药物浓度过大而引起动物死亡。
- 因实验过程中要进行多次静脉注射,应注意保护好家兔耳缘静脉。但保护不好也是正常现象,请参考下文常见问题一节。
- 经常用台氏液或纱布润湿手术野,防止干燥和降温。
常见问题
一. 通用问题
-
动物麻醉相关问题
在实际实验操作中,动物麻醉受到很多因素影响,很可能是整个实验中过程最繁琐、意外最丰富、总耗时最长,也最能开发实验者随机应变、解决问题能力的事项。此处将涵盖多数麻醉过程中可能遇到的问题、解决对策、注意事项以及其他相关信息。
通常而言,注射麻醉剂的速度宜慢不宜快,量宜少不宜多。除严密观察动物整体状态外,也应注意观察耳缘静脉的注射部位及耳根部是否鼓包或存在凝血,确认针头是否进入血管、药物吸收是否顺畅。如果针头未进入血管(表现为注射时漏液、局部皮肤鼓起),应拔出针头再尝试进针;如果针头成功进入血管,但动物耳根部出现明显鼓包,通常是注射太快伤及血管所致,应放慢注射速度或暂停注射,按摩动物耳部促进药物吸收。血管损伤后可能会出现凝血,表现为耳部出现肉眼可见的暗色凝血斑块,拔出针头后用手难以从进针出挤出血液。凝血不严重时,可尝试按摩动物耳部,促进凝血排出或松动;如果凝血严重无法解决,建议换另一侧耳缘静脉再行注射。麻醉剂用量超过理论值50%以后,可以考虑放慢注射速度,每注射1mL观察一段时间,注意动物各状态的变化。麻醉剂吸收起效都需要时间,有时麻醉剂效果不佳的实际原因是等待时间过短,未等至麻醉剂逐渐起效。
如果麻醉剂用料已经到达理论值,等待较长时间后动物麻醉效果却不尽如意,可少量分次补充麻醉剂,注意记录总用量。此时务必仔细观察动物状态,缓慢、少量、分次注射,每补加0.5mL或1mL即观察一段时间,避免过量注射麻醉剂导致动物死亡。待动物肌张力出现肉眼可见的下降,可尝试将动物固定在手术台上,即使动物存在小幅挣扎,只要不至于无法固定即先固定,使动物在手术台上等待麻醉剂起效,同时做其他准备,以免耗时过长。
根据小样本观察,动物如在麻醉前进食,其麻醉剂用量可能大大超出预期,可超出预期至少1倍。这一现象尚没有足够证据证实,但值得留意。
本实验中使用的麻醉剂乌拉坦(氨基甲酸乙酯)对神经影响较小,对多种反射的抑制较弱,因此剪开组织时动物可有小幅度挣扎,属于反射引发的正常现象。如果未见动物明显苏醒挣扎,可不予处置,继续操作并持续观察。
操作过程中,特别是操作时间较长时,有时动物会部分苏醒并试图挣脱手术台上的固定装置,这属于正常现象,解决方法即是补充麻醉剂。推荐每次补0.5mL,补完立即观察动物状态,麻醉效果恢复后即可继续实验。如果过程中有补充麻醉剂,务必记录补充的麻醉剂用量,以便计算总用量。理想情况下,补麻醉剂仍应使用耳缘静脉,但现实情况中,由于操作本身以及某些药物(特别是乳酸)对耳缘静脉的破坏,有可能出现两耳的耳缘静脉都已无法使用,但仍需要补充麻醉剂的情况。根据已有经验,以下替代方式都是可行的:
- 腹腔注射:适用于打开腹腔、暴露消化道之前,具体操作为将针头插入腹部皮下直接注射。
- 肠系膜静脉注射:适用于已打开腹腔、暴露消化道之后。具体操作为寻找小肠系膜上较粗大的静脉,将针头插入静脉直接注射。注意,相对于耳缘静脉,肠系膜静脉更不易止血,注射完成后务必用棉球按压止血,时间可以稍长。曾有因为肠系膜静脉注射后止血不当导致动物大失血死亡的先例,切记!
- 直接腹腔给药:适用于已打开腹腔、暴露消化道之后。具体操作最简单,无需注射,直接将麻醉剂均匀喷淋于腹腔内脏上。
-
如何用止血钳止血
一般类型出血(小静脉或毛细血管)时,找到出血部位,用止血钳用力夹闭即可。如果不慎伤及较大的静脉,出现较慢但难以停止的暗红色出血,应迅速找到静脉远心端,夹闭止血。
手术过程中应尽力避免伤及动脉。如果确实不慎伤及动脉(可见周期性喷射状的鲜红色出血),应尽快找到出血位置,夹闭动脉近心端,以免时间太长造成大失血。
-
气管插管一直失败怎么办?
首先检查切口(特别是横向切口)是否过小,以及气管插管本身是否通畅。确认无误后,反复多次清理气道内血液与粘液,直至基本没有明显的血块出现后,再尝试插管。
一般而言,多次尝试插管后总会有一次可以成功。但值得注意的是,作者本人遇到过无论如何气管插管都无法成功的事例,所幸其时不需要进行呼吸记录,最终放弃了插管。下节实验就是不严格需要气管插管的家兔实验,如果真的遇到此种情况,也可以考虑先不插管,继续后续实验。然而对本次实验而言,作者只能希望大家的实验动物不要出现这样的问题,至少不要在做完呼吸实验前出现。
-
打开颈部之后找不到神经血管怎么办?
提前说明,视野的清晰非常重要。除了尽量扩大切口之外,也应注意及时止血,避免血凝块影响视野。
此部分也推荐在b站等视频网站上搜索相关实验视频,多观察几遍不同人的操作后再进行尝试。
剪开覆盖于气管上的组织并暴露气管后,理论上神经血管都位处气管两侧。扩大包覆气管的组织上的切口,向两侧用力扒开整个切口,在贴近该包覆组织的浅表、气管背侧的两侧,通常可以隐约看到包覆于组织中的两条暗红色(肉眼观察可呈灰黑色)结构,即为颈总动脉。仔细观察颈总动脉旁(可能需要去除部分结缔组织),应能勉强可见与颈总动脉并行的白色结构,即为迷走神经。注意,观察到颈总动脉后的后续分离操作都尽量不要使用剪刀,多用镊子及玻璃分针(特别是分离神经时)。镊子与玻璃分针的分离效率可能较低,请保持耐心,总能分开的,以免伤及血管与神经。
最后,实在找不到或不确定的情况下,请咨询指导老师或助教。
二. 呼吸实验问题
-
注射乳酸后,好像什么现象都没有出现,怎么办?
太长不看:乳酸注射后现象出现的时间可以较长,且现象不一定显著,耐心观察,多记录一段,实在看不出现象可以试试统计分析。
一方面,血液pH下降对呼吸的影响实际上是通过改变脑脊液pH间接引起的,H+扩散入脑脊液需要时间;另一方面,乳酸对局部组织刺激性强,吸收慢,注射后需要多等待一段时间才能有明显吸收,且吸收不一定充分。特别是在乳酸用量少且/或耳缘静脉状态不佳的时候,实际吸收量可能还要更少,有可能造成现象不显著,肉眼观察无法判断。此时应考虑多记录一段时间,从注射开始连续记录5~10min,实验结束后,手动测量注射前和注射后一段时间的呼吸间隔时间,用t检验等统计学方法判断是否有显著差异。
用作者本人的经历作为示例:
注射乳酸后,现场没有观察到明显的现象,但依然进行了较长时间的记录,总记录时间约为7min。实验结束分析数据时,作者注意到把图像放缩得较小时,似乎可以发现在注射乳酸一段时间之后,呼吸频率略有增加。从注射乳酸到呼吸频率略增的这一段延迟时间长达45.25s。
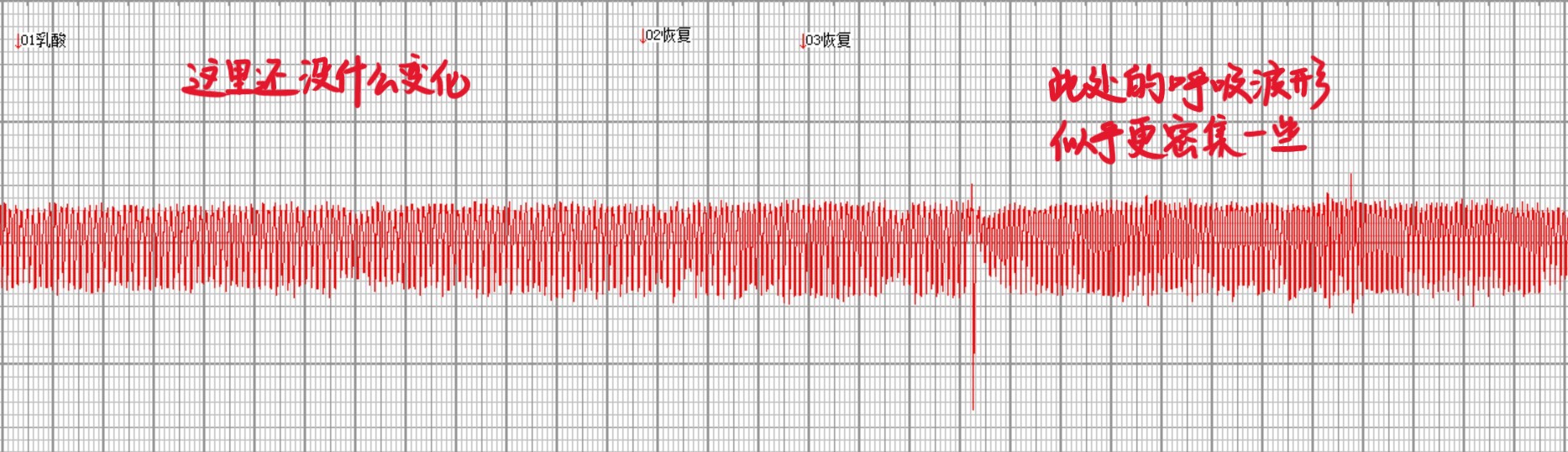
当时由于写实验报告的时间限制,作者后续没有进行更严格的检验,不过如果力求严谨,应随机取一段注射前的呼吸记录和一段怀疑呼吸频率增加时的呼吸记录,手动测量记录当中各次呼吸的间隔,用统计分析方法(如t检验)判断有无显著差异。
-
剪断迷走神经后,似乎也什么都没有发生,怎么办?
剪断一侧迷走神经的现象不一定非常明显。注意观察动物是否出现短暂的不规则呼吸,是否可见一次呼吸的呼气相提前终止、被吸气相打断的现象(这是因为迷走神经的传入有促进吸气相转变为呼气相的作用,剪断一侧后此作用被削弱)。
双侧迷走神经都剪断后,呼吸一般会产生明显的变化,但变化未必非常快速,最明显的趋势是整体变得更慢,每个呼吸波形变宽。很多时候现场观察不如后续分析明显,不需太过担忧。但需要注意的是,补充麻醉剂也会对呼吸产生抑制作用,有可能掩盖剪断神经后的呼吸抑制,如果手术过程中有补充麻醉剂,最好等待一段时间再行实验。
-
刺激迷走神经得到的结果与预期完全不一样,如何是好?
首先说明,迷走神经对呼吸的调节主要是通过传入纤维引起的,剪断后刺激外周端理论上就不会有明显现象。
迷走神经内包含肺牵张反射的传入神经纤维,因此刺激完整迷走神经或其中枢端后的典型现象是吸气受到抑制,甚至呼吸运动可以停在呼气相,出现一段时间的呼吸停止。
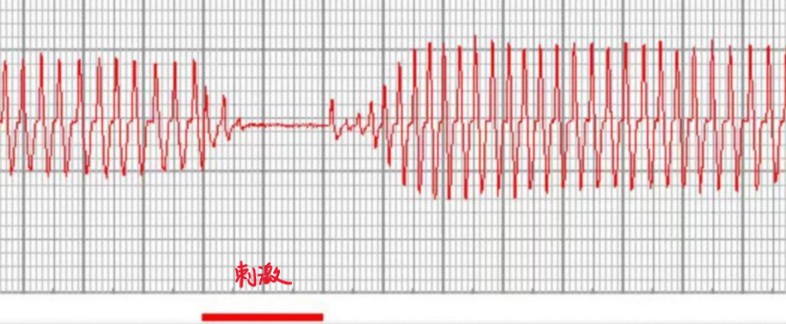
但有时刺激完整迷走神经或刺激迷走神经中枢端时,可以观察到另一种现象,表现为呼吸幅度迅速下降,呼吸频率略上升,呼吸节律变得不规则,不会出现明显的呼吸停止。
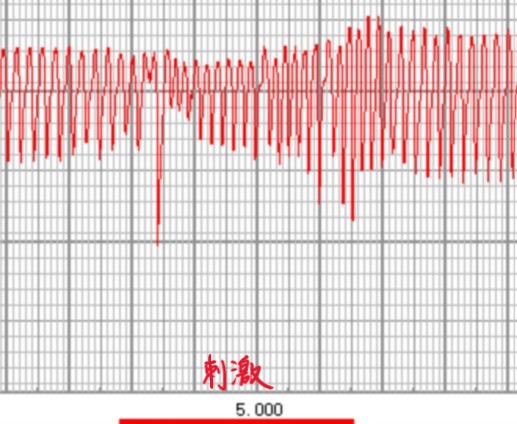
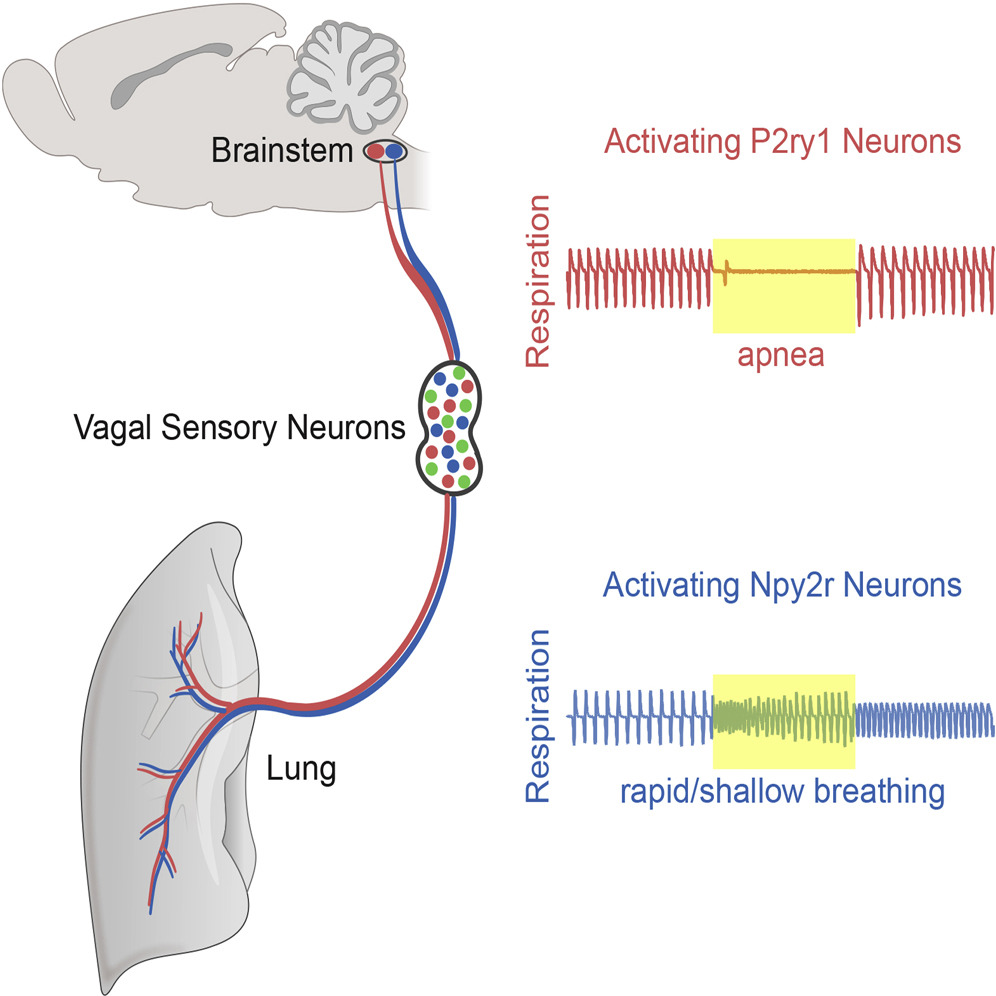
根据目前已有研究,这可能是因为迷走神经内部包含两种不同的传入纤维,其中一种特异表达P2ry1基因,是肺牵张反射的主要传入纤维,激活后引发上述的典型现象,包括呼吸停止;另一种特异表达Npy2r基因,是呼吸道伤害感受的传入纤维,激活后导致动物呼吸幅度降低,呼吸频率上升,类似于受到伤害性刺激后清除呼吸道中有害物质的反应。因为实验条件、刺激方式、个体差异等影响因素的存在,刺激迷走神经时,这两部分传入纤维激活的比例可能不同,造成现象不同,不一定说明实验出了问题。如感兴趣,也可在PubMed上搜索相关资料,或参阅文末的推荐阅读。
三. 消化道实验问题
-
加肾上腺素/刺激迷走神经后似乎没什么反应,怎么办?
肾上腺素对消化道活动整体上是抑制作用,最好找一段活动较为活跃的肠管滴加,否则可能无法形成明显对比。肾上腺素的抑制作用主要来自抑制肠道内在神经系统对肠道平滑肌的激活,比较间接,起效较慢,至少比乙酰胆碱的要慢,可多等待一段时间。
类似地,迷走神经对肠道的激活作用也不全是来自它本身,主要还是来自它对肠道内在神经系统的调节作用,也需要一段时间才能起效。另外,在这里起效的是迷走神经当中的传出神经纤维,如果刺激的是切断后的迷走神经,注意刺激它的外周端,否则不会有明显效果。
-
渗透吸收实验现象不明显
对照肠段不要一次性注入太多液体,否则即使吸收了可能也不明显。如果30min现象仍不显著,可酌情多等待一段时间。
思考题、参考与拓展内容
一. 选做内容
1. 动脉插管
这部分是下次实验需要掌握的技术,可以提前练习。
在左侧颈总动脉的近心端夹一个动脉夹,并在动脉夹远心端距动脉夹约3cm处结扎。用眼科剪在结扎线与动脉夹之间沿向心方向剪一个楔形切口(约占管径的1/3~1/2),向心脏方向插入与压力换能器相连的动脉插管,由备用的线结扎固定。小心松开动脉夹,即可见血液冲进动脉插管。
2. 内脏大神经对消化管运动的调节
打开腹腔,在左侧肾脏的上方找到肾上腺。肾上腺上方较细的神经即为内脏大神经,分离时应特别小心,因稍有不慎便会将其拉断。穿线备用。用保护电极钩住内脏大神经及部分血管和肌肉组织,用中等强度的连续脉冲对其进行刺激,观察消化管运动变化情况。
内脏大神经非常细小,不易辨识,而且极其容易断裂,找不到或不慎将其拉断是非常正常的,成功完成这项实验需要一定的运气。此外,刺激内脏大神经会对血压产生明显的影响,推荐先完成动脉插管、开始血压记录后再寻找内脏大神经,可以通过机械刺激神经再观察血压变化的方式辨认。
二. 思考题
- 试设计实验探索肺缩小反射在呼吸运动中的调节作用。
- 试设计实验研究迷走神经和内脏大神经分别是通过释放什么神经递质来实现对胃肠运动的调节作用。
三. 参考与推荐阅读
- 生理学实验指导.魏香、谢佐平、苏付荣,编著.清华大学出版社,2005.
- 生理学实验指南. 项辉、龙天澄、周文良,主编.科学出版社,2008.
- 生理学实验(第四版).谢景田、刘燕强、崔庚寅,主编.高等教育出版社,2016.
- 生理学(第二版). 姚泰,主编. 北京:人民卫生出版社,2010.
迷走神经与呼吸调控-推荐阅读:
Chang RB et al. Vagal Sensory Neuron Subtypes that Differentially Control Breathing. Cell 161, 622-633 (2015). doi: 10.1016/j.cell.2015.03.022. [在线阅读][查看PDF]
肠道内神经系统对胃肠运动的调控-推荐阅读:
Sanders KM et al. Regulation of gastrointestinal motility–insights from smooth muscle biology. Nature reviews Gastroenterology & hepatology 9, 633–645 (2012). doi: 10.1038/nrgastro.2012.168. [在线阅读][查看PDF]
