胰岛素对小鼠血糖的影响
点击下载 [相关资源]
本篇下载资源为本实验优秀实验报告示例。
目录
- 实验原理与基础知识
- 实验目的
- 实验对象与器材
- 关键实验技术
- 实验过程:血糖检测方法
- 实验过程:小鼠抓取与腹腔注射方法
- 实验过程:胰岛素耐量
- 实验过程:葡萄糖耐量
- 注意事项
- 常见问题
- 思考题、参考与拓展内容
实验原理与基础知识
随血液运输的葡萄糖是供给机体全身组织细胞的重要能源,维持相对稳定的血糖水平对机体来说极为重要。机体有多种维持血糖稳定的负反馈环路,当血糖水平有所下降时,机体的多种升血糖机制将被激活,降血糖机制则受到抑制,促使血糖逐渐回升至正常水平,这一过程中有胰高血糖素、肾上腺素等多种化学信使的参与;反之,当血糖水平由于进食等原因上升时,机体的降血糖机制则会开始发挥作用,促使血糖尽快降至正常水平,这一过程中胰岛素起着最为关键的作用。
胰岛素是由胰岛的β细胞分泌的一种多肽,是调节机体血糖的重要激素之一。它具有复杂多样的生理效应,整体作用基本上是促进储能、合成代谢与生长。胰岛素的短期降血糖作用是通过增加机体组织(特别是肝脏、肌肉和脂肪组织)对血糖的摄取实现的:正常条件下,胰岛β细胞本身摄取葡萄糖的速率大致与血糖含量正相关,当血糖由于进食等原因升高时,β细胞摄取葡萄糖增加,细胞内供能代谢的产能随之增加,使细胞内ATP含量上升。升高的ATP浓度抑制细胞表面ATP敏感的钾通道,导致膜去极化,引发一系列下游反应,增强胰岛素的释放。胰岛素释放入血后随循环扩散至各组织细胞处,与细胞表面的胰岛素受体结合,一方面通过PI3K/Akt通路增加葡萄糖转运体在细胞膜上的含量,直接增强葡萄糖的摄取,起到快速降血糖的作用;另一方面,胰岛素还可对细胞生命活动的其他方面产生复杂的影响,包括上调多种合成代谢、下调多种分解代谢及细胞自噬、改变分泌活动、调节对其他营养物质的摄取等,在长期促进组织利用营养、储存能量以及生长。当胰岛不能分泌足够量的胰岛素,或机体组织对胰岛素的敏感性下降时,将影响机体对葡萄糖的运输和利用,造成高血糖,甚至糖尿病;而体内胰岛素含量增高时,可使血糖短期内快速下降,严重时会导致惊厥、肌肉抽搐、休克等低血糖现象。
机体对血糖变化的调节能力称为糖耐量。如果机体糖耐失衡,无法正常调节血糖,则容易发生低血糖、高血糖或糖尿病等症状。糖耐量一般通过胰岛素耐量实验或葡萄糖耐量实验来检测,可以评估机体对葡萄糖的代谢能力,在实际研究中常以小鼠为对象进行实验,可为糖尿病、肥胖、胰岛素抵抗等代谢性疾病的研究和治疗提供理论指导。
实验目的
- 学习小鼠抓取和腹腔注射给药的方法
- 学习测定小鼠血糖的方法
- 学习葡萄糖耐量实验和胰岛素耐量实验的基本方法
- 了解胰岛素调节血糖水平的机制
实验对象与器材
- 小鼠(Mus musculus),注意记录实验所用的小鼠品系
- 鼠笼,小鼠保定器(1L大量杯), 1mL注射器,手术剪(眼科剪),干棉球,血糖仪,血糖试纸,防抓咬手套,长柄镊,温度计
- 生理盐水,50%葡萄糖注射液,0.2IU/mL胰岛素 (如果实际浓度与此不一致,以实际浓度为准)
关键实验技术
- 小鼠抓取
- 腹腔注射技术
- 小鼠血糖测定方法
实验方法:血糖检测方法
将血糖试纸“插入仪器端”插入血糖仪后部插孔内,血糖仪会自动识别并显示试纸型号,有“血滴”闪烁时将血样轻触血糖试纸“进血端口”,血滴会自动吸入,8s后显示结果。记录结果。记录后,拔出血糖试纸,血糖仪自动保存测定结果并关机。可参考文末提供的小鼠空腹血糖信息,比较实验中实际测得的血糖数值。
将试纸插入血糖仪后,注意血糖仪显示的试纸型号是否与实际相符,相符才能继续进行实验。
实验方法:小鼠抓取与腹腔注射
抓取:提起鼠尾,将小鼠从鼠笼中取出,置于鼠笼顶部。用右手向后轻拉鼠尾,在其向前爬行时,用左手食指与拇指稍用力压住其腰部,并不断向前移动手指,直至小鼠耳部,紧紧抓住两耳及耳间皮肤,将小鼠背部置于掌心,以无名指或小指压住尾巴,以中指置于背下,使其身体平直,头部不能自由转动。
注意,一旦出现抓握不牢固,应立即全部松开小鼠,将置于鼠笼顶部,重新进行抓取。切勿在未抓稳的情况下操作小鼠,或试图在手上调整小鼠抓握方式,有被抓咬的风险!
腹腔注射:左手握小鼠,使其腹面向上,头部略低,右手持吸好药物的1mL注射器,沿腹中线与股骨之间的腹部45°角插入腹腔,将药物注射入腹腔后,缓慢退出针头。
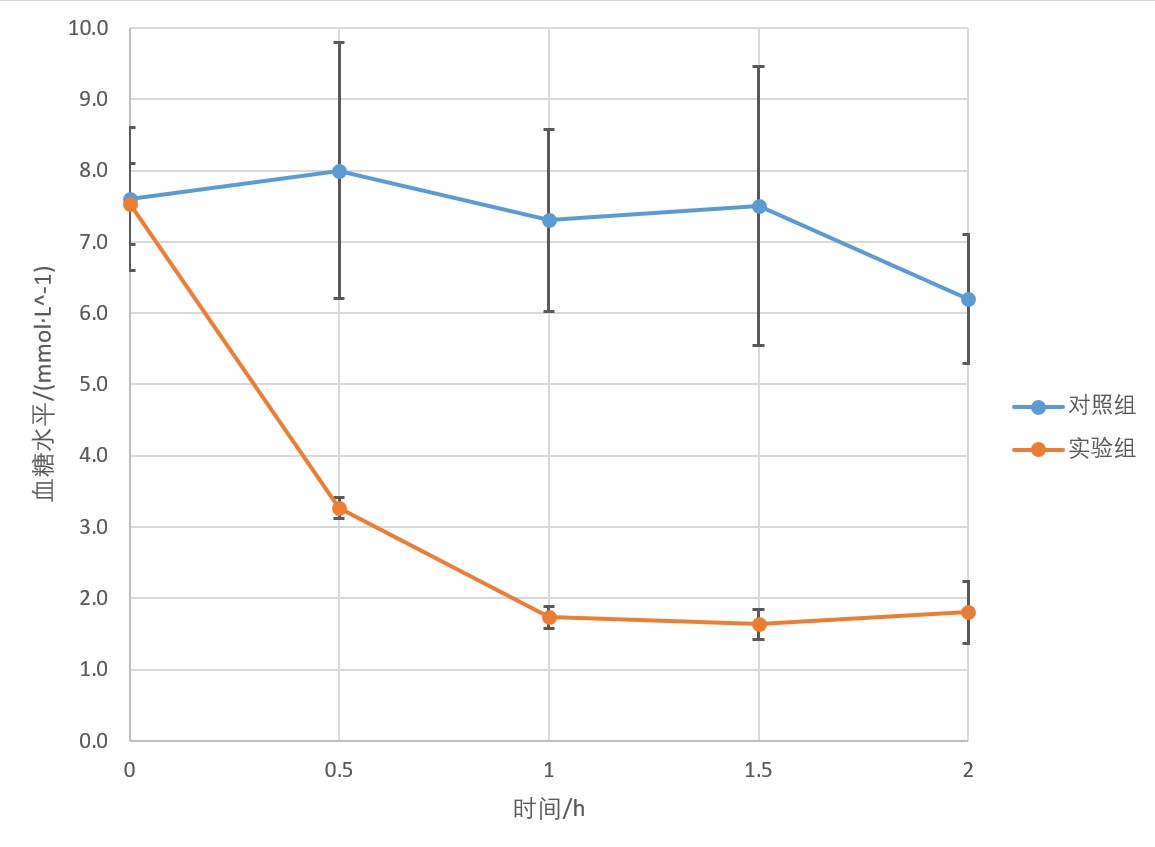
实验10 模型1:小鼠胰岛素耐量实验(ITT)
一. 分组与空腹血糖测定
小鼠随机分为对照组和实验组,每组3只,以尾部划线编号。记录小鼠体重以及实验前禁食时间,通常实验前需禁食4~6h。
用右手抓取鼠尾提起,置于实验台上,快速用1L大量杯罩住小鼠身体,将鼠尾在实验台边缘从量杯的杯嘴(倾液嘴)处拉出。在小鼠尾部末端剪掉约1mm,断尾取血,弃去第1滴血,每次取血约2μL(直径约2mm的血滴),轻触血糖试纸“进血端口”,读取并记录血糖数值,记为初始血糖值。
操作小鼠的人员注意戴好防抓咬手套,避免受伤。
二. 药物注射与后续记录
-
给药
实验组每只腹腔注射胰岛素0.15mL,对照组每只注射生理盐水0.15mL。注射后,将小鼠放在30~37°C环境中保温并观察小鼠状态。
【建议】记录每只小鼠完成注射时的时间,如:对照组1 14:30 对照组2 14:45 ,等等。后续所有时间节点都以每只小鼠的实际注射完成时间为准,如取注射后0.5h的第一个样时,对照组1号小鼠在15:00取样,对照组2号小鼠在15:15取样,等等。
-
取样及数据处理
每隔30min测量并记录一次小鼠血糖浓度,至给药后2h结束(即注射药物后0.5,1.0,1.5,2.0h分别测量并记录小鼠血糖浓度),以mmol/L计。统计小鼠血糖数据,绘制图表,推断胰岛素和小鼠血糖的关系。
过程中如小鼠出现角弓反张、乱滚等惊厥反应,肌肉抽搐、休克等低血糖症状时,及时通过背部皮下注射50%葡萄糖来缓解(不超过0.1mL/10g体重)。
-
动物处死
所有实验结束后,用颈椎脱臼法处死小鼠:右手捏住小鼠尾根部,将小鼠放在笼盖或粗糙台面上,用左手快速的按住其头部。右手提起鼠尾,使其躯干部与台面成约45°夹角,向后上方拉动,使得其第一颈椎与肩关节脱位,小鼠立即死亡。
处死时拉动应快速、用力,不用担心把小鼠尾巴拽断,事实上也拽不断。一般而言,脱位成功后会有一声清脆的声音,并且按压小鼠的手可以清楚地摸到小鼠头颈部中间出现了一个空隙,可注意辨别,用以判断处死是否彻底。
实验10 模型2:小鼠葡萄糖耐量实验(GTT)
小鼠葡萄糖耐量实验包括OGTT(口服葡萄糖耐量实验)、IPGTT(腹腔注射葡萄糖耐量实验)和IVGTT(静脉注射葡萄糖耐量实验),本实验采用IPGTT法。
一. 分组与空腹血糖测定
小鼠随机分为对照组和实验组,每组3只,以尾部划线编号。记录小鼠体重以及实验前禁食时间,通常实验前需禁食4~6h。
用右手抓取鼠尾提起,置于实验台上,快速用1L大量杯罩住小鼠身体,将鼠尾在实验台边缘从量杯的杯嘴(倾液嘴)处拉出。在小鼠尾部末端剪掉约1mm,断尾取血,弃去第1滴血,每次取血约2μL(直径约2mm的血滴),轻触血糖试纸“进血端口”,读取并记录血糖数值,记为初始血糖值。
操作小鼠的人员注意戴好防抓咬手套,避免受伤。
二. 药物注射与后续记录
-
给药
实验组每只注射20%葡萄糖0.3mL,对照组每只注射生理盐水0.3mL。注射后,将小鼠放在30~37°C环境中保温并观察小鼠状态。
【建议】记录每只小鼠完成注射时的时间,如:对照组1 14:30 对照组2 14:45 ,等等。后续所有时间节点都以每只小鼠的实际注射完成时间为准,如取注射后0.5h的第一个样时,对照组1号小鼠在15:00取样,对照组2号小鼠在15:15取样,等等。
-
取样及数据处理
每隔30min测量并记录一次小鼠血糖浓度,至给药后2h结束(即注射药物后0.5,1.0,1.5,2.0h分别测量并记录小鼠血糖浓度),以mmol/L计。统计小鼠血糖数据,绘制图表,推断葡萄糖注射和小鼠血糖的关系。
-
动物处死
所有实验结束后,用颈椎脱臼法处死小鼠,方法与注意事项同前。
注意事项
- 注意记录小鼠在实验前的实际禁食时间
- 动物手术时动作要轻柔,尽量避免对动物的刺激或伤害
- 每次测量结果做好记录
常见问题
-
血糖试纸插入后仪器没有反应
先检查试纸插入方向是否正确以及是否插稳。如果无误,需检查仪器是否有电或损坏,必要时更换仪器尝试。
-
同一组内小鼠的血糖差异都很大,怎么办?
空腹血糖和动物对胰岛素的敏感度都有极大的个体差异,且实验过程中操作小鼠对小鼠造成的刺激也会影响血糖,本实验中每组样本量又较小,组内差异大很正常。在实验现场,只要能看出大致的趋势,就不需要太过担心,一般来说分析数据时一取均值都能看到比较明显的趋势。
当然,担心检测有误时,也不妨借此提醒一下自己,回想一下有没有弃去第一滴血。
-
胰岛素耐量实验中,有小鼠低血糖低得快要死了,怎么办?
除非惊厥太严重影响抓取,小鼠的低血糖反应也不一定会影响测血糖,注意做好小鼠反应的记录即可。
如果确实影响了实验记录,紧急处理可以考虑注射葡萄糖并保温。但要注意,注射葡萄糖本身会对血糖造成影响,理论上注射葡萄糖后,注射葡萄糖的小鼠的数据即不能与其他数据形成有意义的对比。做好处理方式的记录(葡萄糖注射量、保温时间等)。
-
为什么对照组小鼠的血糖也会下降/上升?
属于正常现象,如已确定药物注射无误,一般不需处理。实验的前期步骤需要多次操作小鼠,而且最开始往往不熟练,容易对小鼠造成刺激,而应激本身即会使血糖上升。注射完毕之后,对小鼠的操作减少,而且动作逐渐熟练,对小鼠的刺激较小,小鼠应激状态减轻,血糖即有可能下降。一般而言,只要药物注射正确,对照组血糖即使产生变化,幅度也决然不会大于实验组。
-
关于处理数据的方式
Excel自带的统计与制图功能足够完成本实验中的数据处理。可活用average(取均值)函数和stdev.s(样本标准差)函数计算各统计量。
误差线的设置:制图时,点击图标右上角“+”键,勾选“误差线”一项,点击误差线右侧打开下拉菜单,点击“更多选项”,选择要设置误差线的数据组。
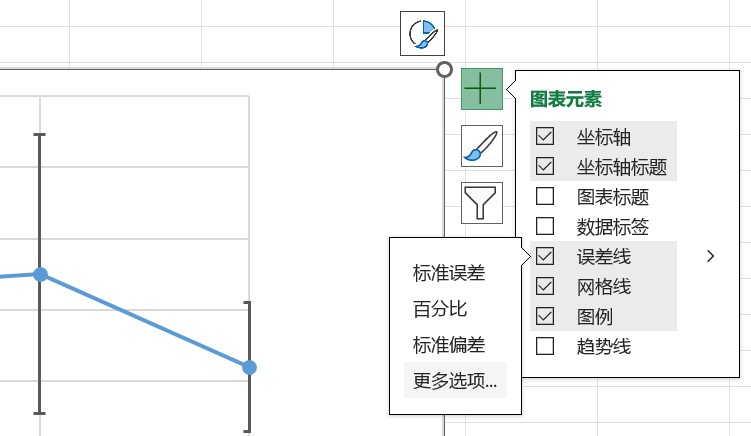
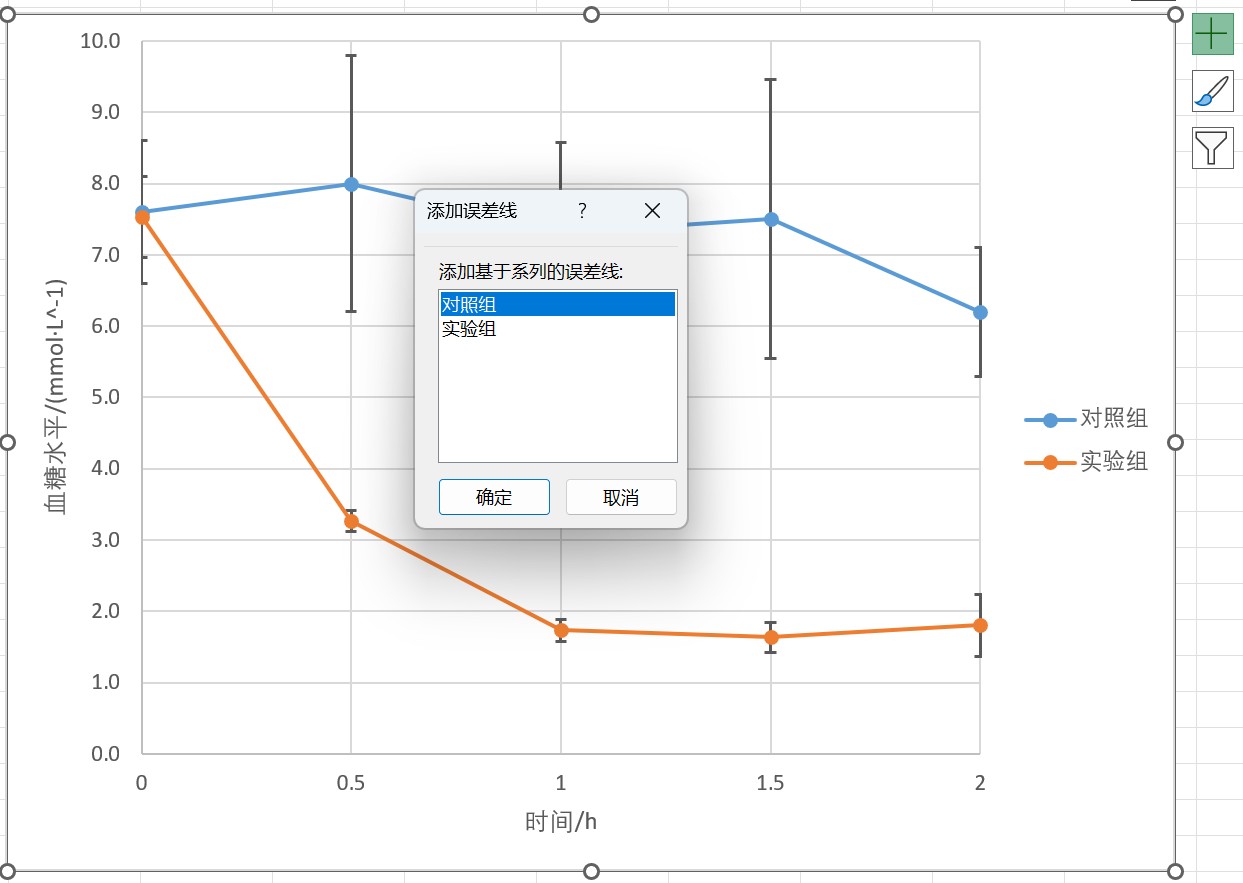
在误差线选项中的“垂直误差线”设置中,勾选“方向”中的“正负偏差”,勾选“误差量”中的“自定义”,点击“指定值”。
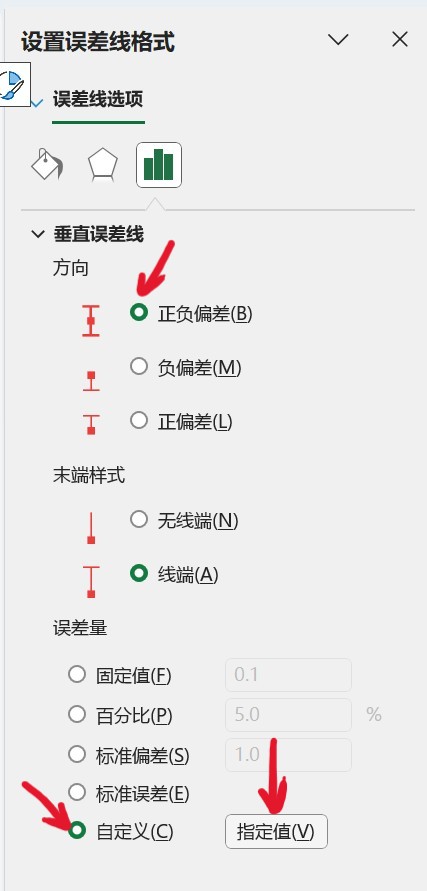
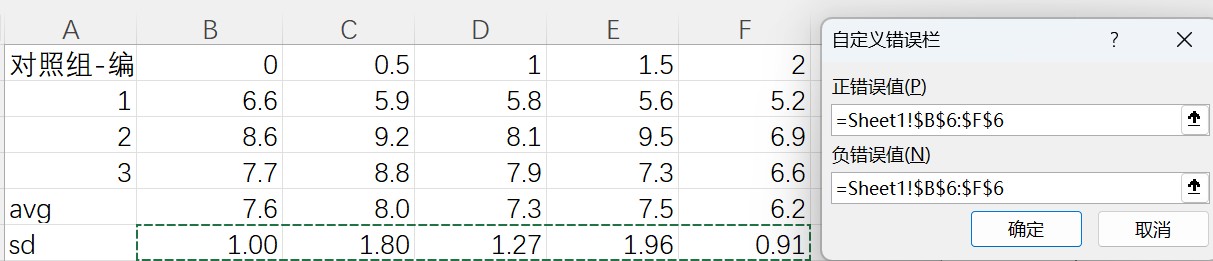
点击后,将正负错误值改为已计算好的标准差值,方式为选中记录标准差值的单元格。完成后,即可获得带误差线的图像。
思考题、参考与拓展内容
一. 选做内容:小鼠灌胃
左手抓握小鼠,右手持吸好药液的灌胃器,沿小鼠嘴角轻轻插入口腔,将灌胃器针头前翘,沿咽后壁轻轻滑入食道约2.5~3cm,将药物轻轻推入胃内后,小心拔出灌胃器。一般小鼠灌胃给药一次给药量为0.1~0.3mL/10g体重。
【注意】灌胃器针头经过喉头时一定要沿咽后壁向下滑,以免误插入气管导致动物窒息死亡。初次尝试时,给药剂量宜少不宜多,太多很容易导致动物窒息死亡。
二. 思考题
- 如果在实验中给小鼠注射的胰岛素过多,会观察到小鼠的什么反应?为什么?
- 试设计实验来测定小鼠血糖的糖阈,也就是不使尿液中出现葡萄糖的最高血糖含量。
- 设计实验,观察高血糖对小鼠的影响。
- 设计实验,研究胰岛素调节血糖的机制当中有哪些组织器官参与了血糖调节。
三. 参考与推荐阅读
- 生理学实验指导.魏香、谢佐平、苏付荣,编著.清华大学出版社,2005.
- 生理学实验指南. 项辉、龙天澄、周文良,主编.科学出版社,2008.
- 生理学实验(第四版).谢景田、刘燕强、崔庚寅,主编.高等教育出版社,2016.
- 生理学(第二版). 姚泰,主编. 北京:人民卫生出版社,2010.
小鼠空腹血糖参考见:Boehm O et al. Clinical chemistry reference database for Wistar rats and C57/BL6 mice. Biological chemistry 388, 547–554 (2007). doi: 10.1515/BC.2007.061. [在线阅读] [查看PDF]
